L'amylose héréditaire ATTR: une maladie systémique potentiellement mortelle1-4
La maladie affecte plusieurs organes et entraîne des symptômes variables1,3,4
Étant donné que les fibrilles amyloïdes se déposent dans les tissus de l’ensemble de l’organisme, y compris les nerfs, le cœur ou le système gastro-intestinal (GI), les patients atteints d’amylose hATTR peuvent présenter un spectre de symptômes sensitifs, moteurs, autonomes et cardiaques.1-5
En réalité, plus de la moitié des patients atteints d’amylose hATTR présentent un phénotype mixte.6,7
Ensemble des signes et symptômes possibles de l’amylose hATTR
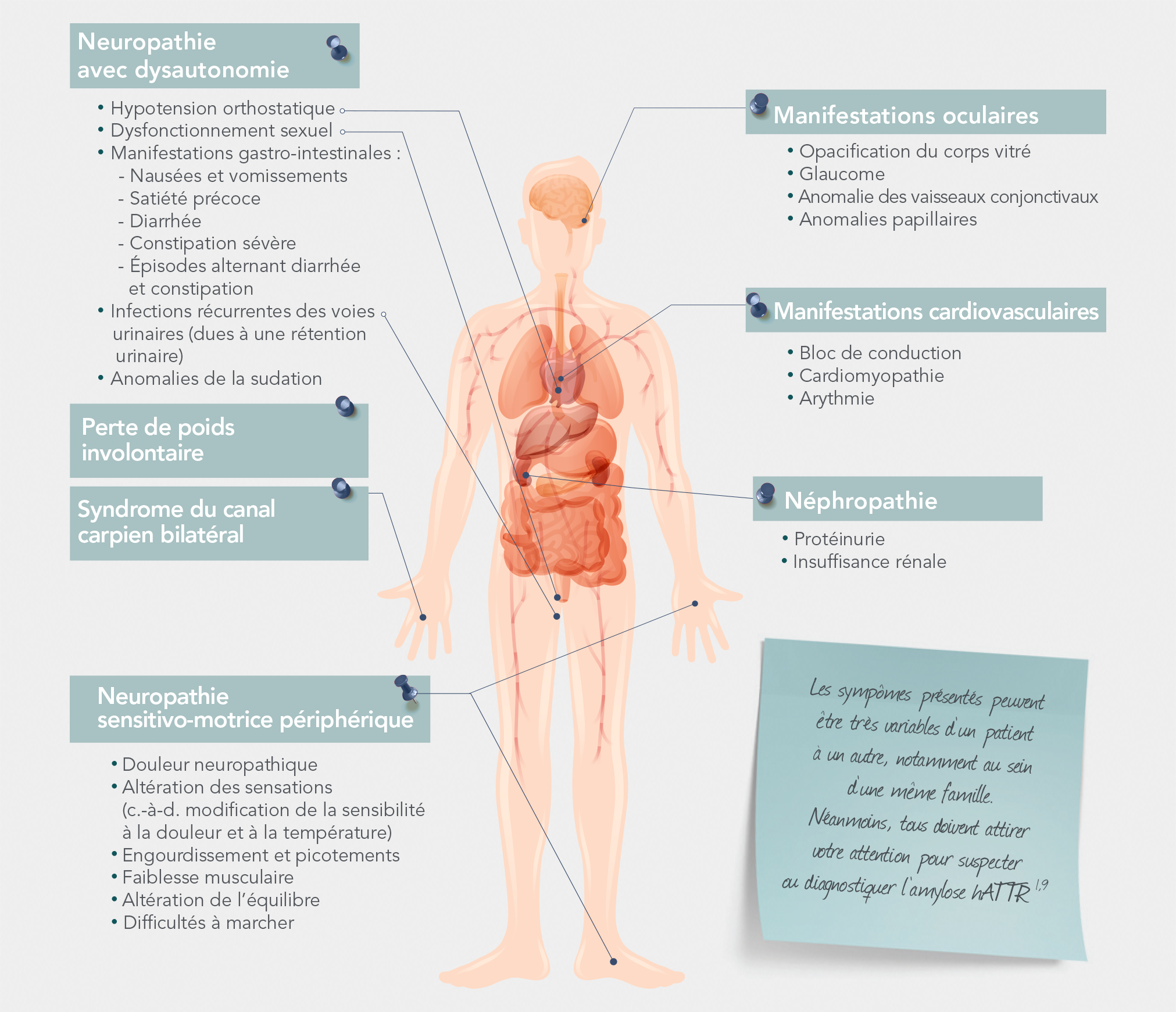
Adapté d’après Conceição I, et al. J Peripher Nerv Syst. 2016;21(1):5-9.
La présentation des symptômes varie considérablement selon les patients, avec mutation. Les symptômes peuvent également varier entre des patients de la même famille8
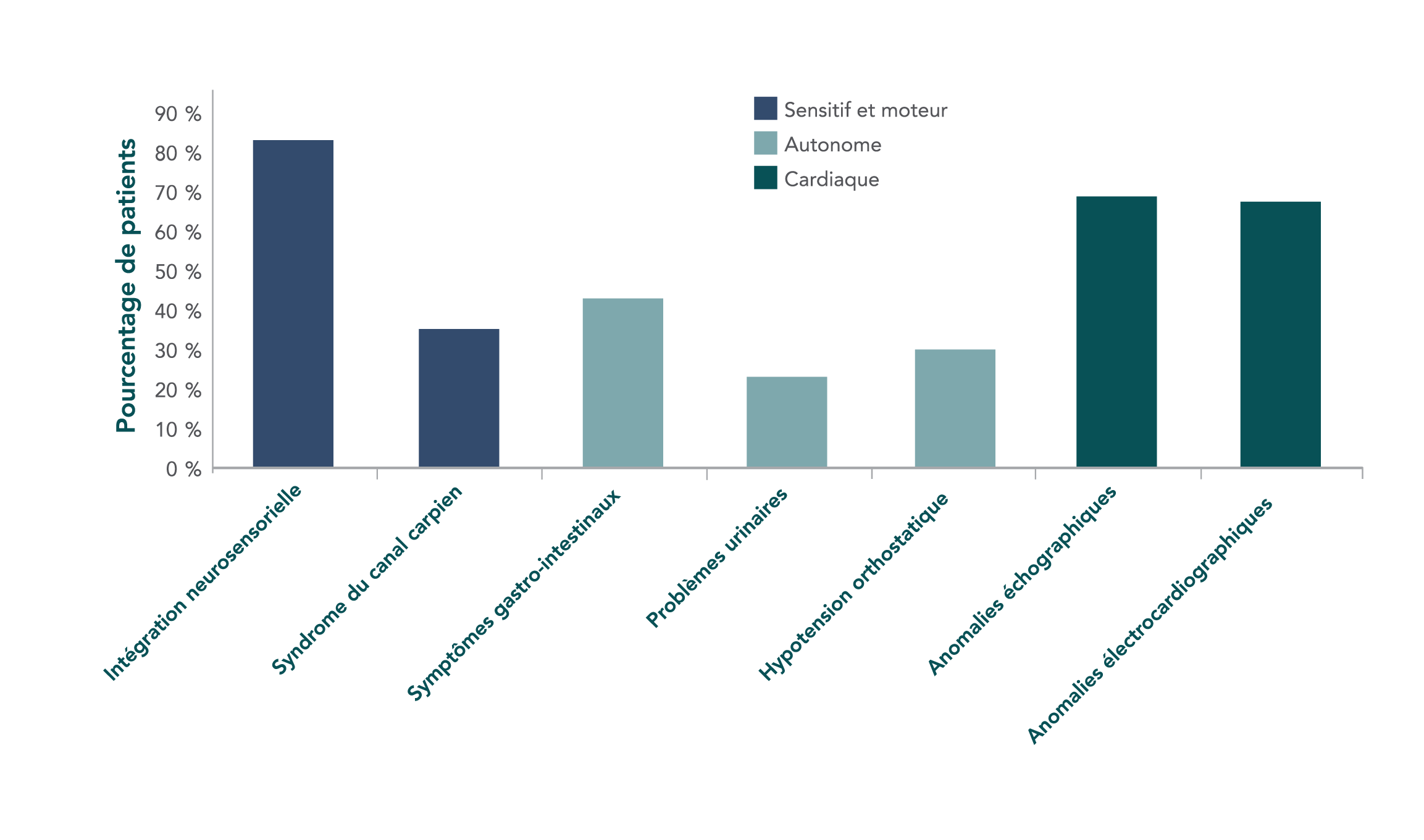
Caractéristiques cliniques de base de 186 personnes atteintes d’amylose ATTR héréditaire, au cours d’une étude multicentrique.6
Les symptômes de l’amylose hATTR peuvent évoluer rapidement, induisant un dysfonctionnement potentiellement mortel2,3,9
À mesure que la maladie évolue, la gravité des symptômes augmente, entraînant une invalidité importante, une moindre qualité de vie et enfin, le décès du patient.9,10 L’amylose hATTR peut entraîner le décès en 2 à 15 ans.2,3,9,11
Références :
- Conceição I, González-Duarte A, Obici L, et al. “Red-flag” symptom clusters in transthyretin familial amyloid polyneuropathy. J Peripher Nerv Syst. 2016;21(1):5-9.
- Hanna M. Novel drugs targeting transthyretin amyloidosis. Curr Heart Fail Rep. 2014;11(1):50-57.
- Mohty D, Damy T, Cosnay P, et al. Cardiac amyloidosis: updates in diagnosis and management. Arch Cardiovasc Dis. 2013;106(10):528-540.
- Shin SC, Robinson-Papp J. Amyloid neuropathies. Mt Sinai J Med. 2012;79(6):733-748.
- Hawkins PN, Ando Y, Dispenzeri A, et al. Evolving landscape in the management of transthyretin amyloidosis. Ann Med. 2015;47(8):625-638.
- Rapezzi C, Quarta CC, Obici L, et al. Disease profile and differential diagnosis of hereditary transthyretin-related amyloidosis with exclusively cardiac phenotype: an Italian perspective. Eur Heart J. 2013;34(7):520-528.
- Adams D, Gonzalez-Duarte A, O’Riordan W, et al., an investigational RNAi therapeutic for the treatment of hereditary ATTR amyloidosis with polyneuropathy: baseline demographics from the phase 3 APOLLO study. In: The XVth International Symposium on Amyloidosis. Uppsala, Sweden: ISA International Society of Amyloidosis; July 3-7, 2016. PA 82.
- Ando Y, Coelho T, Berk JL, et al. Guidelines of transthyretin-related hereditary amyloidosis for clinicians. Orphanet J Rare Dis. 2013;8:31.
- Adams D, Coelho T, Obici L, et al. Rapid progression of familial amyloidotic polyneuropathy: a multinational natural history study. Neurology. 2015;85(8):675-682.
- Adams D, Suhr OB, Hund E, et al. First European consensus for diagnosis, management, and treatment of transthyretin familial amyloid polyneuropathy. Curr Opin Neurol. 2016;29(suppl 1):S14-S26.
- Castano A, Drachman BM, Judge D, et al. Natural history and therapy of TTR-cardiac amyloidosis: emerging disease-modifying therapies from organ transplantation to stabilizer and silencer drugs. Heart Fail Rev. 2015;20(2):163-178.
